Publications
BARGNOUX A-S., PIERONI L., CRISTOL J-P., KUSTER N., DELANAYE P., CARLIER M-C., FELLAHI S., BOUTTEN A., LOMBARD C., GONZALEZ-ANTUNA A., CAVALIER E., DELATOUR V., “Multicenter Evaluation of Cystatin C, Measurement after Assay Standardization”, Clinical Chemistry, 63 (4), 2017, 833-841 ; 9p, DOI: 10.1088/1742-6596/838/1/012025
BRIEUDES V., LARDY-FONTAN S., VASLIN-REIMANN S., BUDZINSKI H., LALERE B., “Development of a multi-residue method for scrutinizing psychotropic compounds in natural waters”, Journal of Chromatography B: Analytical Technologies in the Biomedical and Life Sciences, 1047, 2017, 160-172, 13p, DOI: 10.1016/j.jchromb.2016.07.016
BRINET D., GAIE-LEVREL F., DELATOUR V., KAFFY J., ONGERI S., TAVERNA M., “In vitro monitoring of amyloid betapeptide oligomerization by Electrospray differential mobility analysis: An alternative tool to evaluate Alzheimer's disease drug candidates” Talanta, 165, 2017, 84-91, DOI: 10.1016/j.talanta.2016.12.011
BROS P., JOSEPHS R., STOPPACHER N., CAZALS G., LEHMANN S., HIRTZ C., WIELGOSZ R., DELATOUR V.,” Impurity determination for hepcidin by liquid chromatography-high resolution and ion mobility mass spectrometry for the value assignment of candidate primary calibrators”, Analytical and Bioanalytical Chemistry, 409 (10), 2017, 2559-2567, DOI: 10.1007/s00216-017-0202-4
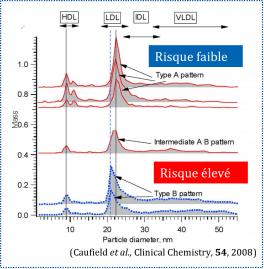
CLOUET-FORAISON N., GAIE-LEVREL F., GILLERY P., DELATOUR V., “Advanced lipoprotein testing for cardiovascular diseases risk assessment: a review of the novel approaches in lipoprotein profiling”, Clinical Chemistry and Laboratory Medicine ; 55 (10), 2017, 1453-1464 ; 12p, DOI: 10.1515/cclm-2017-0091
CLOUET-FORAISON N., GILLERY P., DELATOUR V., “Letter to the Editor regarding Achieving comparability with IFCC reference method for the measurement of hemoglobin A1c by use of an improved isotope-dilution mass spectrometry method”, Analytical and Bioanalytical Chemistry, 409 (24), 2017, 5789-5790 ; 2p, DOI: 10.1007/s00216-017-0513-5
CLOUET-FORAISON N., GAIE-LEVREL F., COQUELIN L., EBRARD G., GILLERY P., DELATOUR V., “Absolute Quantification of Bionanoparticles by Electrospray Differential Mobility Analysis: An application to Lipoprotein Particle Concentration Measurements”, Analytical chemistry, 89 (4), 2017, 2242-2249, 8p, DOI: 10.1021/acs.analchem.6b02909
CLOUET-FORAISON N., GAIE-LEVREL F., DELATOUR V., “Establishing SI-Traceability of Nanoparticle Enumeration Techniques: A Case Study on Electrospray Differential Mobility Analysis”, Journal of Analytical Bioanalytical Techniques ; 8 (4), 2017, 1000370 , 3p, DOI: 10.4172/2155-9872.1000370
DELABY C., BROS P., VIALARET J., MOULINIER A., DELATOUR V., GABELLE A., LEHMANN S., “Quantification of hepcidin-25 in human cerebrospinal fluid using LC-MS/MS”, Bioanalysis, 9, 4, February 2017, 337-347, DOI: 10.4155/bio-2016-0240
DELATOUR V., « Apport de la métrologie avancée à l’évaluation et à l’amélioration de la fiabilité des examens de biologie médicale », Annales des mines : Réalités industrielles, 1, February 2017, 19-23, 5p.
DELATOUR V., MARTOS G., CABILLIC J., PEIGNAUX M., PERROT C., FALLOT C., LALERE B., VASLIN-REIMANN S.; “Reference methods and commutable reference materials for clinical measurements”, Proceedings of the International, School of Physics Enrico Fermi, 196, 2017, 1 – 8, DOI 10.3254/978-1-61499-818-1-1
DELATOUR V., MARTOS G., PEIGNAUX M., LALERE B., VASLIN-REIMANN S., “Reference measurement systems for biomarkers: Towards biometrology”, Proceedings of the International School of Physics Enrico Fermi, 196, 2017, 9 - 24; DOI: 10.3254/978-1-61499-818-1-9
FRANK C., BRAUCKMANN C., PALOS M., ARSENE C.-G., NEUKAMMER J., DEL CASTILLO BUSTO M. E., ZAKEL S. , SWART C., GÛTLER B. AND STOSCH R., “Comparison of Potential Higher Order Reference Methods for Total Haemoglobin Quantification – An Interlaboratory Study, " Anal Bioanal Chem; 2017; 409, Issue 9, 2341–2351 DOI 10.1007/s00216-016-0176-7
GAIE-LEVREL F., BOURROUS S., MACÉ T., “Development of a Portable Reference Aerosol Generator (PRAG) for calibration of particle mass concentration measurements”, Particuology, 37, 2017, DOI: 10.1016/j.partic.2017.06.005
HAERRI H.-P., MACÉ T., WALDÉN J., PASCALE C., NIEDERHAUSER B., WIRTZ K., STOVCIK V., SUTOUR C., COUETTE J. AND WALDÉN T., “Dilution and permeation standards for the generation of NO, NO2 and SO2 calibration gas mixture”, Meas. Sci. Technol., 28, 035801 (17pp), 2017, DOI: 10.1088/1361-6501/aa543d
HIRTZ C., LEHMANN S., BREDE C., LESCUYER P., COCHO J.A., VIALARET J., BROS P., DELATOUR V., HIRTZ C., “Clinical mass spectrometry proteomics (cMSP) for medical laboratory: What does the future hold ?,” Clinica Chimica Acta, 467, April 2017, 51-58 ; 8p, DOI: 10.1016/j.cca.2016.06.001
LARDY-FONTAN S., LE DIOURON V., DROUIN C., LALERE B., VASLIN-REIMANN S., DAUCHY X., ROSIN C., “Validation of a method to monitor the occurrence of 20 relevant pharmaceuticals and personal care products in 167 bottled waters”, Science of the Total Environment ; 587-588, 2017, 118-127 ; 10p, DOI: 10.1016/j.scitotenv.2017.02.074
MANIXAY S., DELABY S., GAIE-LEVREL F., WIART M., MOTZKUS C. AND BENCSIK A, “In vivo evaluation of the potential neurotoxicity of aerosols released from mechanical stress of nano-TiO2 additived paints in mice chronically exposed by inhalation”, Journal of Physics: Conference Series, 838, 2017, DOI: 10.1088/1742-6596/838/1/012025
RICCI M., SHEGUNOVA P., CONNEELY P., BECKER R., LE DIOURON V., LARDY-FONTAN S., LALERE B., “CCQM-K102: polybrominated diphenyl ethers in sediment >Track A> - Low polarity analytes in abiotic matrix”, Metrologia, 54, technical supplement 08026, 82 DOI: 10.1088/0026-1394/54/1A/08026
WAI-MEI SIN D., WONG Y-C., LEHMANN A., SCHNEIDER R., CABILLIC J., LARDY-FONTAN S., “CCQM-K126: low polarity organic in water: carbamazepine in surface water”, Metrologia, 54, 2017, technical supplement, 08030, 56, DOI: 10.1088/0026-1394/54/1A/08030
Communications
ALASONATI E., “Metrological characterization of nanoparticles in environmental matrices by A4F and SP-ICPMS“, EU Cost Action ES1205, Aveiro, Portugal; February 2017
FISICARO P., VASILEVA E., FETTIG I., KOSCHORRECK J., PIECHOTTA C., OSTER C., ALASONATI E., DEL CASTILLO BUSTO M. E., AZEMARD S., “Collaborative study on mercury and methylmercury quantification in fish samples from the German Environmental Specimen Bank“; Winter Plasma Conference, Autriche, February 2017
DELATOUR V., "EQAS relying on commutable CRMs", Séminaire LABAC, Paris, 08 mars 2017
LARDY-FONTAN S., LE DIOURON V., FALLOTC ., LALERE B, « Développement, validation et mise en œuvre d’une méthode par dilution isotopique/spectrométrie de masse pour le dosage des hormones stéroïdiennes dans le contexte de la Watch List », Paris, SEP 2017, 28-31 mars 2017
FISICARO P.,« SP-ICPMS: “Metrological challenges and first developments at LNE“, CCQM Inorganic Analysis Working Group, BIPM Sevres; Avril 2017
ALASONATI E., PIECHOTTA C., WITTSTOCKC., FETTIG I, FISICARO P., “Traceability for speciation of mercury in water and biota“, Workshop on mercury monitoring and regulation, Germany; April 2017
FISICARO P., VASILEVA E., FETTIG I., KOSCHORRECK J., PIECHOTTA C., OSTER C., ALASONATI E., DEL CASTILLO BUSTO M E., AZEMARD S.; “Development of an enzymatic digestion method for the quantification of mercury species in biota and fish“; Workshop on mercury monitoring and regulation; April 2017, Allemagne
PIECHOTTA C., WITTSTOCK C., FETTIG I., ALASONATI E., FISICARO P., “Development of an enzymatic digestion method for the quantification of mercury species in biota and fish“, Workshop on mercury monitoring and regulation; April 2017, Allemagne
DELATOUR V., "Laboratory test standardization in clinical chemistry", Spring Symposium of the Korean Society for Clinical Laboratory, Daejeon, Corée du Sud; Avril 2017
ALASONATI E., « Caractérisation métrologique des oxydes de titane et silice par A4F-UV-MALS », Journée Scientifique G4F, Paris; Mai 2017
LALERE B., DIOURON V., FALLOT C., S. LARDY-FONTAN, «Développement, validation et mise en œuvre d’une méthode par dilution isotopique/spectrométrie de masse pour le dosage des hormones stéroïdiennes dans le contexte de la Watch List », Club AFSEP Ile de France, Rouen, 23 mai 2017
MAZZELLA N., TOGOLA A., LARDY-FONTAN S., MATHON B., DABRIN A., GHESTEM J-P., TIXIER C., GONZALEZ J-L., BOTTA F., MIEGE C., “Passive samplers for monitoring priority micropollutants in surface waters: a national scale study“, IPSW, Toronto (Canada), 29 mai au 02 juin 2017
DELATOUR V., "The importance of reference methods and commutability ", Congrès IFCC, Athènes, Grèce, Juin 2017
ADRIAAN VAN DER VEEN M.H., MURUGAN A., LI J., HEINONEN M., HALOUA F., ARRHENIUS K., HAFNER K., CULLETON L., LESTREMAU F., HÖGSTRÖM R., GAIE-LEVREL F., DESCHERMEIER R., PERUZZI A., PÉREZ F., DEL CAMPO D., CAMORRO C., BERANEK J., VALKOVÀ M., FÜKÖ J., CHOU M.-H., “Metrology for Biogas“, GAS Analysis 2017, Rotterdam (Pays-Bas), 13-15 Juin 2017.
MACE T., SUTOUR C., présentation orale, “Development of formaldehyde reference materials“, Gas analysis 2017, Rotterdam (Pays-Bas), 13-15 juin 2017.
MOTZKUS C., GAIE-LEVREL F., FELTIN N., DELABY S., «Etude du relargage de nano-objets manufacturés en fonction du vieillissement de matériaux nanocomposites dédiés au bâtiment» : projet EMANE. Colloque Adebiotech, Qualité de l’Air Interieur, un enjeu de santé publique, Romainville – Grand Paris (France), 27-28 juin 2017.
CLOUET-FORAISON N., DELATOUR V., GAIE-LEVREL F., « Analyses de Bio-nanoparticules par ES-DMA», Journée technique TSI, LNE Paris, 29 Juin 2017
WANG J., FISICARO P., BENEDETTI M., “Characterization and Quantification of Engineered and Natural Nanoparticles in Small Watersheds of Seine River with Different Land Use“, Goldschmidt, Paris ; August 2017
MARTOS G., GIANGRANDE C., DELATOUR V., LALERE B.,« La standardisation des mesures protéiques : du diagnostic de la maladie d’Alzheimer à la prévention de la résistance antimicrobienne», 18e Congrès international de métrologie, Paris, France, 19-21 septembre 2017
HÖGSTRÖM R., VESALA H., HEINONEN M., GAIE-LEVREL F., TARGAN T., “Particulate content of biogas“, Congrès International de Métrologie, CIM 2017, Paris (France), 19-21 septembre 2017
GUIGUES N., «Quelle mesure pour la qualité de l'eau 2017», 18e Congrès international de métrologie, Paris, France, 19-21 septembre
GUIGUES N., LEPOT B., CABILLIC J., RAVEAU S., FERRET C., MARESCAUX N. “Performances of measuring devices for monitoring organic matter and nutrients in the Oise River“, France, SWIG Sensing for Water, Nottingham, 28 septembre 2017
FISICARO P.,“Characterisation of nanoparticles in complex matrices by UV-MALLS-FFF” Workshop : “Inorganic nanoparticles in food and other matrices”, CCQM Inorganic Analysis Working Group, Torino, Italy; 28 September 2017
ALASONATI E, « Fractionnement par couplage flux-force hydraulique couplé à la diffusion statique de la lumière : une méthode pour la caractérisation métrologique de la taille des nanoparticules » , Journée Technique GT3, Paris; Octobre 2017
JITARU P., CHEKRI R., LAVISON-BOMPARD G., FISICARO P., SEBY F., VACCHINA V., GUÉRIN T. AND DONARD O., "PRO-METROFOOD project: involvement of the French node in setting up a novel European research infrastructure in food and nutrition"; 3rd IMEKOFOODS, Metrology Promoting Harmonization& Standardization in Food & Nutrition; 1st – 4thOctober 2017, Thessalonique, Grèce
VERRON JP, CESAR F, BROCARD G, LARDY-FONTAN S, LALERE B, YARDIN C, CONIL S, REDON PO,. VILLENEUVE A, GALY C., “Archiving a territory: Challenges and Opportunities. “, 4th International Conference on Environmental Specimen Banks, Bilbao 2-4 October 2017
LARDY-FONTAN S., MEGHARFI M., VERRON J P., CÉSAR F., GALY C., LALERE B., “Why Collaboration Between National Metrology Institute and Environmental Specimen Bank: A French demonstration between LNE and Andra’s Ecotheque“ , 4th International Conference on Environmental Specimen Banks, Bilbao 2-4 October 2017
TOGOLA A., LARDY-FONTAN S., LESTREMAU F., MARGOUM C., “Non-target screening and environmental specimen banking: French perspectives“, 4th International Conference on Environmental Specimen Banks, Bilbao 2-4 October 2017
STOICA D., FISICARO P., “Ocean acidification: an emerging metrological challenge, IMEKO/MetroSeaNaples, Italy, 11-13 Octobre 2017
STOICA D., FISICARO P., “Ocean acidification: an emerging metrological challenge“, IMEKO/MetroSeaNaples, Italy, 11-13 Octobre 2017
MATHON B., MAZZELLA N., DABRIN A., MIEGE C., TOGOLA A., GHESTEM J-P., EL MOSSAOUI M., TIXIER C., GONZALEZ J-L., ANDRAL B., LARDY-FONTAN S., « Accompagner le transfert des échantillonneurs passifs vers les opérateurs pour le suivi chimique des eaux », Journée retour d'expérience du 1er cycle DCE "Eaux littorales" Nantes le 15-16 novembre 2017.
GIANGRANDE C., "LCMS methods and traceability of CSF biomarker measurements", JCTLM Stakeholders meeting, Sèvres, France, Décembre 2017