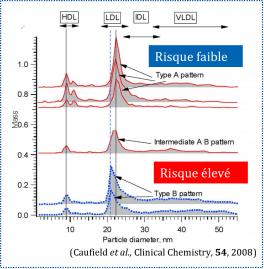
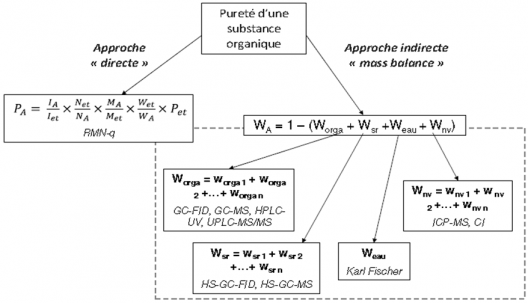
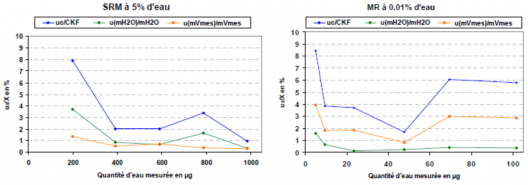
Les maladies neurodégénératives (MND) constituent un défi majeur pour la société en matière de santé, avec chaque année plus de 9,9 millions de nouveaux cas de démence identifiés dans le monde. Un diagnostic plus précis et plus précoce permettrait un traitement plus efficace et améliorerait la prévision de la progression de la maladie.
Objectif
Evaluer et améliorer l’exactitude et la comparabilité des dosages de la protéine Tau pour permettre le diagnostic fiable et précoce de la maladie d’Alzheimer.
Résumé et premiers résultats
Les maladies neurodégénératives (MND) sont l’un des problèmes médicaux les plus pressants de notre époque, avec un nouveau cas toutes les 3,2 secondes. De nombreuses MND, en particulier les maladies d’Alzheimer et de Parkinson, sont irréversibles et progressives. Outre leur coût socioéconomique élevé, ils nuisent gravement à la qualité de vie des patients et de leurs aidants. Un diagnostic précoce grâce à la mise en œuvre de programmes de dépistage, à l'identification de facteurs de risque et au développement de traitements modificateurs de la maladie est essentiel pour améliorer la qualité de vie des patients souffrant de MND.
L’objectif du projet est de faire progresser la quantification des biomarqueurs de MND dans les fluides biologiques en utilisant des méthodes peu invasives, pour développer des critères d’évaluation validés centrés sur la personne et axés sur le déclin des fonctions cognitives chez les patients atteints de MND et pour définir des prototypes de référence métrologique pour la cognition.
En 2018, Pfizer a mis fin à ses efforts pour développer de nouveaux médicaments pour les maladies d’Alzheimer et de Parkinson, après de nombreux échecs d'essais cliniques. L'échec de ces essais est à attribuer à divers facteurs, notamment le manque de mesures précises et la faible implication de la cible dans le recrutement.
Les preuves suggèrent que les changements dans le cerveau associés à la maladie d’Alzheimer commencent plus de 20 ans avant l'apparition des symptômes et que le traitement de la maladie est plus efficace lorsqu'il est commencé tôt dans le processus. Bien que les outils et l'expertise permettant d'identifier certains des premiers changements cérébraux existent actuellement, des recherches supplémentaires sont nécessaires pour affiner ces outils et établir leur précision, avant qu'ils ne puissent être utilisés en clinique.
Le programme Big Data for Better Outcome a été lancé en 2017 en Europe dans le but d'utiliser le Big Data dans le secteur de la santé et de promouvoir les critères d’évaluation centrés sur la personne. Ces dernières années, des progrès considérables ont été accomplis dans le domaine des biomarqueurs de MND dans les fluides biologiques. Deux biomarqueurs ont été approuvés par l'Agence médicale européenne pour des essais cliniques et inclus dans des directives de diagnostic. Des lignes directrices sur l'échantillonnage pré-analytique ont également été élaborées et le premier matériau de référence certifié MND a été introduit en 2017. Malgré tout, il est nécessaire de développer davantage les procédures de mesure de référence pour les biomarqueurs établis de MND, tels que tau, ainsi que de définir des seuils cliniques cibles pour l'identification de biomarqueurs.
L'imagerie par résonance magnétique (IRM) à 3 Tesla est largement utilisée dans les cliniques pour confirmer le diagnostic du MND et peut fournir des informations précieuses sur la structure du cerveau et les changements dus aux MND. Les utilisations de l'IRM et de la spectroscopie à résonance magnétique (SRM) ont un potentiel élevé pour stratifier les patients atteints de MND aux premiers stades de la maladie, mais jusqu'à présent, la mise en œuvre était limitée par la forte incertitude de mesure et l'amplitude intrinsèque du signal (en particulier pour les neurométabolites) dans des intensités de champ de 3 T.
Ainsi le projet se propose de développer des critères d’évaluation novateurs et validés, centrés sur la personne pour le diagnostic précoce du MND axé sur le déclin des fonctions cognitives chez les patients. L'utilisation potentielle de telles évaluations cognitives dans les programmes de dépistage devrait également être évaluée.
Des protocoles améliorés d'imagerie par résonance magnétique (IRM) et de spectroscopie (MRS) seront développés ainsi que des procédures de mesure de référence utilisant des techniques de résonance magnétique à très haut champ in vivo, afin d'identifier et de quantifier les biomarqueurs chez les patients atteints de MND. En outre, de nouvelles techniques seront développées afin d’augmenter la spécificité des méthodes d’IRM et de MRS pour la discrimination des MND. Par ailleurs, des méthodes validées et des étalons traçables pour la mesure précise des biomarqueurs de MND dans les fluides biologiques (incertitude cible <10%) seront développés. Cela devrait inclure le développement de nouvelles procédures de mesure de référence pour les biomarqueurs établis tels que le neurofilament (diagnostic précoce), les fragments de tau et tau phosphorylé (progression de la maladie) et la définition de seuils cliniques cibles pour l'identification de biomarqueurs.
Impacts scientifiques et industriels
Adoption de la technologie et de l'infrastructure de mesure par la chaîne d'approvisionnement des mesures, les organismes de normalisation (ISO/TC 212, Fédération internationale de chimie clinique (IFCC) et Comité mixte pour la traçabilité en médecine de laboratoire (JCTLM)) et les utilisateurs finaux (par exemple, laboratoires cliniques, hôpitaux).
Partenaires
LGC (Royaume-Uni), PTB (Allemagne), RISE (Suède), Centre Hospitalier Universitaire Montpellier (France) Charite - Universitaetsmedizin Berlin (Allemagne), Högskolan Kristianstad (Suède), Modus Outcomes SAS (France), Stichting VUmc (Pays-Bas), Universitätsmedizin Greifswald - Körperschaft des öffentlichen Rechts (Allemagne)